课程内容
《糖类(1)》
学习目标
1、了解糖类的组成和分类方法。
2、掌握葡萄糖的结构特点和化学性质。
3、初步了解有机化合物的对映异构现象。
学习重点:葡萄糖的化学性质
阅读与交流(P79)
1、什么叫糖?
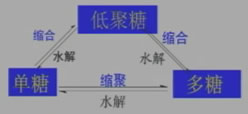
2、什么叫单糖、低聚糖和多糖?
3、葡萄糖的存在和物理性质?
糖类:一般是多羟基醛或多羟基酮,以及它们的脱水缩合物。
分类——能否水解以及水解产物的多少
①单糖——不能再发生水解的糖
葡萄糖、果糖、半乳糖、山梨糖
②低聚糖——能水解成较少分子单糖的糖(≤10)
蔗糖、麦芽糖、纤维二糖和乳糖
③多糖——能水解成多分子单糖的糖(>10)
淀粉、纤维素
多糖属于天然高分子化合物。
交流与讨论
分析糖类化合物在组成上具有怎样的特征?为什么人们曾把糖类物质称为“碳水化合物”?
组成:由C、H、O元素组成,常用通式Cn(H2O)m来表示。
符合这个通式的化合物都是糖类物质吗?
不符合这个通式的化合物就不是糖类物质吗?
糖类之间的关系
科学推理:
根据下列信息推出葡萄糖的分子结构:
1、在一定条件下,1mol葡萄糖与1molH2反应,还原成己六醇
说明分子中有双键,也说明是直链化合物
2、葡萄糖能发生酯化反应生成五乙酸葡萄糖醋(提示:同一个C原子上连接2个羟基不稳定)
说明葡萄糖分子中有5个-OH,且分别连在5个C原子上
3、葡萄糖分子被氧化,碳链并不断裂,而是生成含6个C原子的葡萄糖酸
一、葡萄糖与果糖
1、葡萄糖 分子式:C6H12O6
2、果糖 分子式:C6H12O6
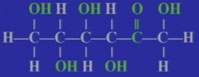
葡萄糖和果糖互为同分异构体。
3、葡萄糖的物理性质及存在
无色晶体,熔点为146℃,有甜味,但甜度不如蔗糖,易溶于水,稍溶于乙醇,不溶于乙醚。
葡萄糖存在于葡萄及其他带有甜味的水果、蜂蜜中,植物的种子、叶、根、花中。
4、葡萄糖的化学性质
葡萄糖是一种多羟基醛。
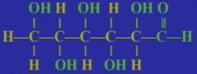
结构简式:CH2OH(CHOH)4CHO
所含官能团:醛基、醇羟基
化学性质:醛基的性质
醇羟基的性质
①醛基的性质:氧化性、还原性
Ⅰ银镜反应
Ⅱ与新制Cu(OH)2反应
现象:得绛蓝色溶液,生成砖红色沉淀。
Ⅲ与H2加成生成己六醇。
②羟基的性质:
与活泼金属反应产生H2
与酸发生酯化反应
思考:若1mol葡萄糖完全酯化,需要乙酸多少摩尔?
③生理氧化反应:人体能量的主要来源
葡萄糖还可以被强氧化剂完全氧化成二氧化碳和水
④葡萄糖在酒化酶的作用下发酵生成乙醇
5、葡萄糖的制法
(C6H10O5)n+nH2O→n(C6H12O6)
淀粉 葡萄糖
6、葡萄糖的用途
营养物质、制药工业、镀银工业、制酒工业
生活中——糖果,酒
工业上——制镜
医药上——迅速补充营养
7、果糖
分子式:C6H12O6
结构简式:
CH2OHCHOHCHOHCHOHCOCH2OH
多羟基酮,是葡萄糖的同分异构体。
物理性质:
纯净的果糖为无色晶体,熔点为103-105℃,不易结晶,通常为粘稠性液体,易溶于水、乙醇和乙醚。果糖是最甜的糖,广泛分布在植物中,水果和蜂蜜中含量最高。
化学性质:
在碱性条件下,果糖分子中羰基受多个羟基的影响有很强的还原性,所以果糖能被银氨溶液和新制氢氧化铜氧化。果糖是还原糖。
在酸性条件下,果糖不被溴水氧化,可用溴水区分葡萄糖和果糖。
碳原子上连有四个不相同的原子或原子团,这样的碳原子叫做“不对称碳原子”,也叫做“手性分子”。
巩固练习:
1、下列关于糖类说法不正确的是( )
A、主要来源是光合作用
B、人体所需的营养素之一
C、生物体维持生命活动所需能量的唯一来源
D、糖类与生物体的结构有关
2、葡萄糖不能发生下列反应中的( )
A、酯化反应
B、加成反应
C、氧化反应
D、水解反应
3、下列关于糖类的叙述正确的是( )
A、糖是有甜味的物质
B、含有C、H、O三种元素的有机物叫做糖
C、是指多羟基醛或多羟基酮以及能水解生成它们的物质
D、糖类物质均能发生银镜反应
课后思考:
患有糖尿病的人的尿液中含有葡萄糖,设想怎样去检验一个病人是否患有糖尿病?