课程内容
《研究有机化合物的一般步骤和方法(1)》
教学目标:
1、掌握有机化合物分离提纯的常用方法和分离原理
2、了解鉴定有机化合物结构的一般过程与方法
教学重点:
有机化合物分离提纯的常用方法和分离原理
怎样获得一种纯净的有机产品呢?
考虑:
(1)来源:天然或人工合成
(2)分离提纯的方法
(3)确定分子结构:组成元素(实验式)
分子组成(分子式)
分子结构(结构式)
即研究有机化合物要经过以下几个步骤:
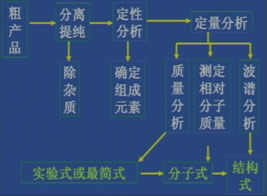
每一个操作步骤是怎样完成的呢?
【思考与交流】
1、常用的分离、提纯物质的方法有哪些?
2、下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)NaCl(泥沙) (2)酒精(水)
(3)甲烷(乙烯)
(4)乙酸乙酯(乙酸)
(5)溴水(水) (6)KN03(NaCl)
3、归纳分离、提纯物质的总的原则是什么?
分离除杂的基本原则:
不增、不减、易分、复原
1、化学方法:一般是加入或通过某种试剂进行化学反应。
2、物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的常用物理方法:蒸馏、重结晶、萃取、分液
一、分离、提纯
1、蒸馏:利用混合物中各种成分的沸点不同而使其分离的方法,如石油的分馏;常用于分离提纯液态有机物;
条件:有机物热稳定性较强、含少量杂质、与杂质沸点相差较大(30℃左右)
课本P17实验1-1工业乙醇的蒸馏
蒸馏 加吸水剂
含杂工业乙醇——→95.6%(m/m)工业乙醇———→无水乙醇(99.5%以上)
蒸馏
蒸馏的注意事项:
·注意仪器组装的顺序:“先下后上,由左至右”;
·不得直接加热蒸馏烧瓶,需垫石棉网;
·蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;需使用沸石;
·冷凝水水流方向应与蒸汽流方向相反(逆流;下进上出);
·温度计水银球位置应与蒸馏烧瓶支管口齐平,以测量馏出蒸气的温度。
例题1:现有一瓶A和B的混合液,已知A和B的某些性质如下表:
物质
分子式
熔点/℃
沸点/℃
密度/g·cm-3
水溶性
A
C3H6O2
-98
57.5
0.93
可溶
B
C4H8O2
-84
77
0.90
可溶
由此,分离A和B的最佳方法是( )
A、萃取 B、升华 C、蒸馏 D、分液
练习:欲用96%的工业酒精制取无水乙醇时,可选用的方法是( )
A、加入无水CuSO4,再过滤
B、加入生石灰,再蒸馏
C、加入浓硫酸,再加热,蒸出乙醇
D、将96%的乙醇溶液直接加热蒸馏出苯
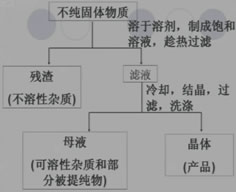
2、重结晶:
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
关键:选择适当的溶剂。
选择溶剂的条件:
(1)杂质在溶剂中的溶解度很小或很大;
(2)被提纯的有机物在此溶剂中的溶解度受温度的影响较大。
洗涤沉淀或晶体的方法:
用胶头滴管往晶体上加蒸馏水直至晶体被浸没,待水完全流出后,重复两至三次,直至晶体被洗净。
检验洗涤效果:
取最后一次的洗出液,再选择适当的试剂进行检验。
【思考与交流】
1、如何提取溴水中的溴?
2、实验原理是什么?
3、用到的实验仪器(玻璃仪器)有哪些?
4、如何选取萃取剂?
3、萃取:
原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
主要仪器:分液漏斗
萃取的条件:
(1)萃取剂和原溶剂互不相溶和不发生化学反应
(2)溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
操作过程:震荡-静置-分液
萃取包括:
(1)液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机
物从一种溶剂转移到另一种溶剂的过程。
(2)固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程。(专用仪器设备)
常见的有机萃取剂:
乙醚、石油醚、二氯甲烷、四氯化碳……
【练习1】下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A、乙酸乙酯和水,酒精和水,植物油和水
B、四氯化碳和水,溴苯和水,苯和水
C、甘油和水,乙酸和水,乙酸和乙醇
D、汽油和水,苯和水,己烷和水
蒸馏、分液、萃取的区别
(1)蒸馏:分离或提纯沸点不同的液体混合物可采取蒸馏的方法。
(2)分液:利用互不相溶的液体密度的不同,用分液漏斗将它们一一分离出来。
(3)萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
【练习2】下列实验装置不适用于物质分离的是( )
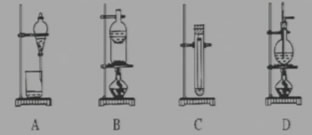
【练习3】可以用分液漏斗分离的一组液体混和物是( )
A、溴和四氯化碳 B、苯和甲苯
C、汽油和苯 D、硝基苯和水
4、色谱法:阅读P19
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
例如:用粉笔分离色素……
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教中级职称
善于因材施教,针对不同学生的心理,采用不同的教学方法,以求达到更好的学习境界。