课程内容
《盐类的水解(1)》
实验探究
动动手:检测下列溶液显酸性、碱性、中性?
(1)CH3COONa (2)Na2CO3
(3)NH4Cl (3)Al2(SO4)3
(5)KNO3
实验结果统计分析及推理:
| 测试对象 | 生成该盐的 | 盐的类型 | 溶液酸碱性 | |
| 酸 | 碱 | |||
| CH3COONa | CH3COOH | NaOH | 强碱弱酸盐 | 碱性 |
| Na2CO3 | H2CO3 | NaOH | 碱性 | |
| NH4Cl | HCl | NH3·H2O | 强酸弱碱盐 | 酸性 |
| Al2(SO4)3 | H2SO4 | Al(OH)3 | 酸性 | |
| KNO3 | HNO3 | KOH | 强酸强碱盐 | 中性 |
讨论:CH3COONa的水溶液显碱性的原因:
(1)写出醋酸钠在水溶液中电离的方程式?
(2)写出水电离的方程式?
(3)CH3COONa溶液中存在着几种离子?
(4)溶液中哪些离子可以结合成弱电解质?
(5)生成弱电解质时对水的电离平衡有何影响?
醋酸钠在溶液中的变化:
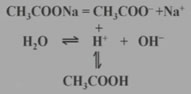
CH3COONa+H2O
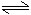 CH3COOH+NaOH
CH3COOH+NaOHCH3COO-+H2O
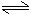 CH3COOH+OH-
CH3COOH+OH-讨论:试从CH4COONa的水溶液显碱性的原因分析:
为什么NH4Cl的水溶液显酸性?
氯化铵在溶液中的变化:
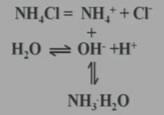
NH4Cl+H2O
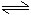 NH3·H2O+HCl
NH3·H2O+HClNH4++H2O
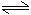 NH3·H2O+H+
NH3·H2O+H+一、盐类的水解
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
对概念的理解
水解的实质:破坏(促进)了水的电离平衡。
水解反应与中和反应的关系:

讨论:以NaCl为例,说明强酸和强碱生成的盐能否水解?
规律:
有弱才水解
都弱都水解
越弱越水解
谁强显谁性
书写水解离子方程式的注意点:
CH3COO-+H2O
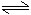 CH3COOH+OH-
CH3COOH+OH-NH4++H2O
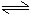 NH3·H2O+H+
NH3·H2O+H+书写水解离子方程式的注意点:(一般情况下)
(1)盐类水解的程度较小,用可逆号“
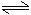 ”表示。
”表示。(2)盐类水解的产物很少,不会产生气体或沉淀,不标“↓”或“↑”。
(3)不把生成物(如H2CO3等)写成其分解产物的形式。
练习
1、下列离子在水溶液中不会发生水解的是( )
A、NH4+ B、SO42- C、Al3+ D、F-
2、下列溶液PH小于7的是( )
A、溴化钾 B、硫酸铜
C、硫化钠 D、硝酸钡
3、下列溶液能使石蕊指示剂显红色的是( )
A、碳酸钾 B、硫酸氢钠
C、硫酸钠 D、氯化铁



























