课程内容
《化学反应进行的方向》
自发过程:在一定条件下,不借助外部力量就能自动进行的过程。
自发反应:在一定条件下不需要外界帮助就能自动进行的反应,称为自发反应。
问题与思考
自然界中水总是从高处往低处流;
电流总是从电位高的地方向电位低的地方流动;
室温下冰块自动融化;
墨水扩散;
食盐溶解于水。
这些生活中的现象将向何方发展,我们非常清楚,因为它们有明显的自发性——其中是否蕴藏了一定的科学原理?
能量由高到低
1、能量判据(焓判据)
日常生活中长期积累的经验而总结得到一条经验规律→能量判据(焓判据):体系趋向于从高能状态转变为低能状态(这时体系会对外做功或者释放热量即△H<0)。
结论:△H<0有利于反应自发进行,但自发反应不一定要△H<0。
焓变只是反应能否自发进行的一个因素,但不是惟一因素。只根据焓变来判断反应方向是不全面的。
2、熵判据
火柴散落过程混乱度如何变化?
从混乱度角度分析它们为什么可以自发?
【归纳与总结】
自发过程的体系趋向于由有序转变为无序,导致体系的熵增大,这一经验规律叫做熵增原理,也就是反应方向判断的熵判据。
混乱度越大越稳定,△S>0有利于反应自发进行。
导致混乱度增加的一些因素
1、同一物质气态时熵值最大,液态较小,固态时最小。
2、固体的溶解过程,墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增加的反应。
自发反应一定是熵增加的反应吗?
结论:△S>0有利于反应自发进行,自发反应不一定要△S>0。
要正确判断一个化学反应能否自发进行,必须综合考虑反应的焓变△H和熵变△S自由能变化△G
自由能变化△G综合考虑了焓变和熵变对体系的影响
△G=△H-T△S
当△G>0时,反应为非自发反应。
当△G<0时,反应为自发反应。
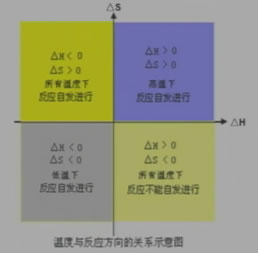
温度与反应方向的关系示意图
判断298K时下列反应能否自发进行
2KClO3(s)=2KCl(s)+3O2(g)
△H=-78.03kJ·mol-1
△S=+494.4J·mol-1·K-1
CaCO3(s)=CaO(s)+CO2(g)
△H(298K)=+178.2kJ·mol-1
△S(298K)=+169.6J·mol-1·K-1
【注意】
1、反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生和过程发生的速率。例如涂有防锈漆和未涂防锈漆的钢制器件,二者发生腐蚀过程的自发性是相同的,但只有后者可以实现。
2、在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。例如水泵可以把水从低水位升至高水位;高温高压下可以使石墨转化为金刚石,实现的先决条件是要向体系中输入能量,该过程的本质仍然是非自发性的。
焓减小有利于反应自发,熵增大有利于反应自发。
【课堂达标测试】
1、下列过程是非自发的是( )
A、水由高处向低处流; B、天然气的燃烧;
C、铁在潮湿空气中生锈 D、室温下水结成冰。
2、碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A、其分解是因为生成了易挥发的气体,使体系的熵增大;
B、其分解是因为外界给予了能量;
C、其分解是吸热反应,据能量判据不能自发分解;
D、碳酸盐都不稳定,都能自发分解。
3、下列说法正确的是( )
A、凡是放热反应都是自发的,由于吸热反应都是非自发的;
B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;
C、自发反应在恰当条件下才能实现;
D、自发反应在任何条件下都能实现。
4、下列说法不正确的是( )
A、焓变是一个与反应能否自发进行有关的因素,多数的能自发进行的反应都是放热反应。
B、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大。
C、一个反应能否自发进行取决于该反应放热还是吸热。
D、一个反应能否自发进行,与焓变和墒变的共同影响有关。
5、以下自发反应可用能量判据来解释韵是( )
A、硝酸铵自发地溶于水
B、2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol
C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);△H=+74.9kJ/mol
D、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol



























