课程内容
《化学平衡 图像问题》
一、浓度-时间图:
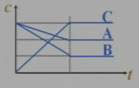
可用于:
(1)写出化学反应方程式:
A+2B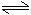 3C
3C
(2)求反应物的转化率:
A的转化率=33.3%
B的转化率=66.7%
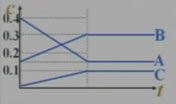
(1)写出化学反应方程式:
5A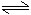 3B+2C
3B+2C
(2)求反应物的转化率:
A的转化率=62.5%
浓度-时间图像的关键:
1、何为反应物、生成物
2、反应物、生成物计量数关系
3、是否为可逆反应
练习:
例1:今有正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如右图所示,(1)该反应的反应物是_______(2)该反应的化学方程式为______________
(3)分析从t2到t3时刻曲线改变的原因是( )
A、增大了X或Y的浓度 B、使用了催化剂
C、缩小体积,使体系压强增大 D、升高了反应温度
二、速度-时间图
可用于:
(1)已知引起平衡移动的因素,判断反应是吸热或放热反应,反应前后气体体积的变化。
(2)已知反应,判断引起平衡移动的因素。
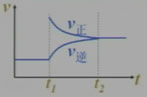
引起平衡移动的因素是增大反应物浓度,平衡将向正方向移动。
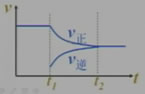
引起平衡移动的因素是减小生成物浓度,平衡将向正方向移动。
已知对某一平衡改变温度时有如下图变化,则温度的变化是升高,平衡向正反应方向移动,正反应是吸热反应。
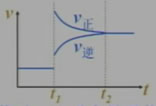
若对一正反应是吸热反应的可逆反应平衡后降低温度,画出平衡移动过程中的v-t图。
对于mA(g)+nB(g)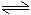 pC(g)+qD(g),改变压强时有如下图变化,则压强变化是增大,平衡向逆反应方向移动,m+n<p+q。
pC(g)+qD(g),改变压强时有如下图变化,则压强变化是增大,平衡向逆反应方向移动,m+n<p+q。
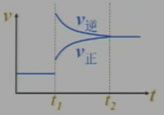
若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的v-t图。
对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
由于v正、v逆均有不同程度的增大,引起平衡移动的因素可能是a、升高温度b、增大压强。根据反应方程式,升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。
对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
由于v正、v逆相同程度的增大,t1时的改变因素可能是a、加入(正)催化剂b、当m+n=p+q时增大压强。平衡没有移动。
练习
1、以mA(g)+nB(g) pC(g)为例,若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H____0,m+n____q。
pC(g)为例,若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H____0,m+n____q。
三、某物质的转化率(或百分含量)-时间-温度(或压强)图:
对于反应mA(g)+nB(g)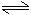 pC(g)+qD(g)
pC(g)+qD(g)
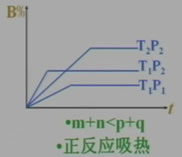
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
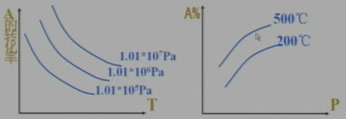
正反应放热m+n>p+q 正反应放热m+n<p+q
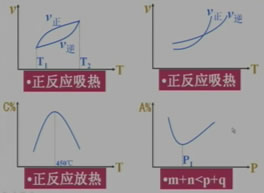
五、其他
对于反应mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
练习
2、(2004年广东18)右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A、升高温度 B、加大X的投入量
C、加催化剂 D、减小体积
5、图表示反应N2(g)十3H2(g)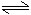 2NH3(g),△H=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氢的百分含量最高的一段时间是( )
2NH3(g),△H=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氢的百分含量最高的一段时间是( )
A、t0~t1 B、t2~t3
C、t3~t4 D、t5~t6


























