课程内容
《等效平衡》
学习目标:
1、理解和掌握等效平衡的概念
2、理解几种类型的等效平衡及分析方法
3、提高分析问题和解决问题的能力
等效平衡
相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,达到平衡时,任何相同物质的百分含量(体积分数、质量分数或物质的量分数)都相同的化学平衡互称等效平衡。
等效平衡的判断方法
任何状态的体系,都用“极端状态”来比较,通过可逆反应的化学计量数换算成同一边物质。
等效平衡建成条件探究一
恒温恒容: 2SO2(g) + O2(g)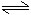 2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 0 0 2mol
途径3起始 1mol 0.5mol 1mol
(1+1)mol (0.5+0.5)mol 0
途径4起始 0.5mol 0.25mol 1.5mol
途径5起始 amol bmol cmol
【问题】①途径2、3与1等效吗?
②途径4中O2(g)和SO3(g)的起始量为多少,到达平衡时可与途径1等效?
③途径5中a、b、c符合怎样的关系达到平衡状态时与途径1等效?
恒温恒容:等效平衡建成条件
结论:
恒温恒容条件下,对于反应前后气体分子数发生变化的可逆反应,若改变起始加入情况,通过可逆反应的化学计量数换算成同一边物质的物质的量与原平衡起始加入量相同,则二者平衡等效。
等效平衡建成条件的探究二
恒温恒容:等效平衡建成条件
结论:
恒温恒容条件下对于反应前后气体分子数不变的可逆反应,若改变起始加入情况,只要通过可逆反应的化学计量数换算成同一边物质的物质的量之比与原平衡起始加入量相同,则二者平衡等效。
等效平衡建成条件的探究三
恒温恒压: 2SO2(g) + O2(g)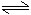 2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4mol 2mol 0
途径1和2是否为等效平衡?
恒温恒压: H2(g) + I2(g)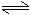 2HI(g)
2HI(g)
途径1起始 2mol 1mol 0
途径2起始 4mol 2mol 0
途径1和2是否为等效平衡?
结论:
恒温恒压条件下若改变起始加入情况,只要通过可逆反应的化学计量数换算成同一边物质的物质的量之比与起始加入量相同,则两平衡等效。
等效平衡小结
| 条件 | 等效条件 | 结果 |
| 恒温恒容(△n(g)≠0) | 投料换算成相同物质表示时物质的量相同 | 两平衡各组分百分含量均相同(n、c相同) |
| 恒温恒容(△n(g)=0) | 投料换算成相同物质表示时物质的量成比例 | 两平衡各组分百分含量相同(n、c按比例变化) |
| 恒温恒压 | 投料换算成相同物质表示时物质的量成比例 | 两平衡各组分百分含量相同(c相同,n按比例变化) |
等效平衡问题总结:
等效平衡的条件
对mA(g)+nB(g)
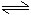 pC(g)+qD(g)
pC(g)+qD(g)1、如果m+n≠p+q
恒温恒容:相同起始物质的物质的量相等
恒温恒压:相同起始物质的物质的量之比相等
2、如果如果m+n=p+q
相同起始物质的物质的量之比相等
练习
在一恒容的容器中充入2mol A和1mol B,发生反应2A(g)+B(g)
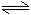 xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则 x的值为( )
xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则 x的值为( )A、只能为2 B、只能为3 C.可能是2,也可能是3 D、无法确定
























