课程内容
《化学平衡常数》
【学习目标】
1、化学平衡常数的概念
2、运用化学平衡常数对化学反应进行的程度判断
3、运用化学平衡常数进行计算
根据表中的数据计算出平衡时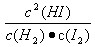 的值,并分析其中的规律。
的值,并分析其中的规律。
通过分析实验数据得出:
(1)温度不变(保持457.6℃)时,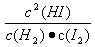 为常数,用K表示,K=48.74;
为常数,用K表示,K=48.74;
(2)常数K与反应的起始浓度大小无关;
(3)常数K与正向建立还是逆向建立平衡无关即平衡建立的过程无关。
化学平衡常数
1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数(简称平衡常数)。
2、表达式:
mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
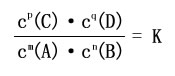
3、平衡常数的单位
∵浓度的单位为mol·L-1
∴K的单位为(mol·L-1)△n
当浓度的单位为mol·L-1,称标准平衡常数,平衡常数一般不写单位。
4、化学平衡常数的意义:
定量的衡量化学反应进行的程度
(1)K值越大,表示反应进行的程度越大,反应物转化率也越大。
(2)一般当K>105时,该反应基本进行完全;
当K<10-5时,认为该反应未发生。
5、使用平衡常数应注意的几个问题
(1)化学平衡常数的大小只与温度有关,与反应物或生成物的浓度无关。
(2)在平衡常数表达式中,纯液体(如水)的浓度、固体物质的浓度不写。
(3)化学平衡常数表达式与化学方程式的书写有关。
(4)同一化学反应,正、逆反应的平衡常数互为倒数。
6、化学平衡常数的应用
(1)判断可逆反应是否达到平衡及反应方向
对于可逆反应,在一定温度的任意时刻,反应物的浓度和生成物的浓度有如下关系:
mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
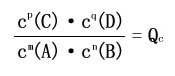 叫该反应的浓度熵。
叫该反应的浓度熵。
①Qc<K,反应向正方向进行
②Qc=K,反应处于平衡状态
③Qc>K,反应向逆方向进行
例题:高炉炼铁中发生的基本反应如下:
FeO(s)+CO(g) Fe(s)+CO2(g);△H>O,其平衡常数可表达为:K=c(CO2)/c(CO),已知1100℃,K=0.263。1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态____(填“是”或“否”),此时化学反应向____方向进行,其原因是________。
Fe(s)+CO2(g);△H>O,其平衡常数可表达为:K=c(CO2)/c(CO),已知1100℃,K=0.263。1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态____(填“是”或“否”),此时化学反应向____方向进行,其原因是________。
(2)利用K可判断反应的热效应
根据某反应的平衡常数K随温度变化的情况,可判断该反应是放热反应还是吸热反应。
①若升高温度,K值增大,则正反应为吸热反应。
②若升高温度,K值减小,则正反应为放热反应。
7、有关化学平衡常数的计算
平衡转化率:
对于可逆反应mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
α(A)%=(A的初始浓度-A的平衡浓度)/A的初始浓度×100%
α(A)%=(A初始的物质的量-A的平衡物质的量)/A初始的物质的量×100%
例1:在某温度下,将H2(g)和I2(g)各O.1mol混合物充入10L的密闭容器中,充分反应达到平衡时,测得c(H2)=0.0080mol/L,求:
(1)反应的平衡常数。
(2)其它条件不变,充入的H2(g)和I2(g)各0.2mol,求达平衡时各物质的平衡浓度。
例2:反应N2(g)+3H2(g)=2NH3(g)在一定条件下进行。设投入的N2为1mol,H2为3mol,在一体积恒定,温度恒定的容器中反应,测得平衡时的压强是原来的90%,求转化率α1。然后再充入1molN2和3molH2,温度不变,计算新平衡的转化率α2。
例3:已如CO(g)+H2O(g)=CO2(g)+H2(g) 800℃ K=1.0;求恒温恒容体系中,用c(CO):c(H2O)=1:1或1:4开始,达到平衡时CO和H2O(g)的转化率。
课堂小结:
(1)平衡是有条件的、动态的。
(2)K不随起始浓度大小而变化。
(3)K与温度有关。
(4)K与方程式写法有关。
(5)K值大小标志反应能达到的最大限度,K值越大,反应物的转化率越大,反应越完全。
(6)K值可用于判别反应进行的方向和判断反应的热效应。
























