课程内容
《影响化学反应速率的因素(2)》
有效碰撞:能够发生化学反应的碰撞。
活化分子:有可能发生有效碰撞的分子。
活化能:活化分子所多出普通分子的那部分能量。
活化能和反应速率的关系:活化能越低,单位体积内活化分子数越多,化学反应速率就会越快。
用碰撞模型解释化学反应速率的快慢
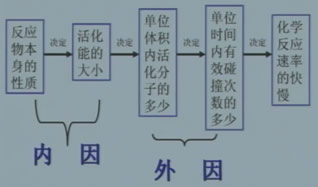
碰撞理论解释浓度对反应速率的影响
浓度增大→单位体积内n总↑→单位体积内n活↑→有效碰撞↑
碰撞理论解释压强对反应速率的影响
压强增大→浓度增大→单位体积内n活↑→有效碰撞↑
碰撞理论解释温度对反应速率的影响
升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
催化剂对反应速率的影响
催化剂改变了反应的历程,降低了活化能,改变反应速率。
小结:影响化学反应速率的外因
|
影响 外因 |
单位体积内 | 有效碰撞次数 | 化学反应速率 | ||
| 分子总数 | 活化分子数 | 活化分子百分数 | |||
| 增大反应物浓度 | 增加 | 增加 | 不变 | 增加 | 加快 |
| 增大压强 | 增加 | 增加 | 不变 | 增加 | 加快 |
| 升高温度 | 不变 | 增加 | 增加 | 增加 | 加快 |
| 正催化剂 | 不变 | 增加 | 增加 | 增加 | 加快 |
可逆反应中:外界条件同时对V正、V逆影响
浓度:
增大反应物浓度,V正急剧增大,V逆逐渐增大;
减小反应物浓度,V正急剧减小,V逆逐渐减小。
压强:
加压对有气体参加或生成的可逆反应,V正、V逆均增大,气体分子数大的一侧增大的倍数大于气体分子数小的一侧增大的倍数;降压V正、V逆均减小,气体分子数大的一侧减小的倍数大于气体分子数小的一侧减小的倍数。
温度:
升温,V正、V逆一般均加快,吸热反应增大的倍数大于放热反应增加的倍数;
降温,V正、V逆一般均减小,吸热反应减小的倍数大于放热反应减小的倍数。
催化剂
加催化剂可同倍地改变V正、V逆。
巩固练习
1、下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
2、下列说法正确的是( )
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
3、下列有关说法正确的是( )
A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大
C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
高考链接
(08广东卷)对于反应2SO2(g)+O2(g)
 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )A、通入大量O2 B、增大窗口容积
C、移去部分SO3 D、降低体系温度





















