课程内容
《醇和酚(一)》
教学目标:
1、掌握乙醇的主要化学性质和结构。
2、了解醇的分类和命名。
3、了解醇类的一般通性和典型醇的用途。
重点:乙醇的化学性质
羟基化合物:烃分子中氢原子被羟基取代后得到的物质。
羟基(-OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(-OH)与苯环直接相连的化合物称为酚。
一、醇
1、醇的分类:
(1)根据所含羟基的数目
一元醇:只含一个羟基 饱和一元醇通式:CnH2n+1OH或CnH2n+2O
二元醇:含两个羟基
多元醇:多个羟基
(2)根据羟基所连烃基的种类
脂肪醇:包括饱和和不饱和
脂环醇
芳香醇
2、饱和一元醇的命名
(1)选主链 选含-OH的最长碳链为主链,称某醇
(2)编号位 从离-OH最近的一端起编号
(3)写名称 取代基位置-取代基名称-羟基位置-母体名称(羟基位置用阿拉伯数字表示:羟基的个数用“二”、“三”等表示。)
芳香醇命名时,常常把苯环作为取代基。
3、醇的同分异构体
醇类的同分异构体可有:
(1)碳链异构
(2)羟基的位置异构
(3)相同碳原子数的饱和一元醇和醚是官能团异构
4、同系物的物理性质比较:
醇的沸点远高于烷烃。
醇羟基越多沸点越高。
乙二醇沸点高于乙醇,1,2,3-丙三醇的沸点高于1,2-丙二醇,1,2-丙二醇的沸点高于1-丙醇,其原因是:由于羟基数目增多,使得分子间形成的氢键增多增强,熔沸点升高。
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。
随碳原子的数目增多,醇的溶解性减小。
二、乙醇
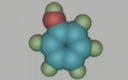
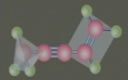
(一)乙醇的结构
从乙烷分子中的1个H原子被-OH(羟基)取代衍变成乙醇。
(二)乙醇的物理性质
颜色:无色透明
气味:特殊香味
状态:液体
挥发性:易挥发
密度:比水小
溶解性:跟水任意比互溶,能够溶解多种无机物和有机物
(三)乙醇的化学性质
1、取代反应
(1)与金属Na的取代 (2)分之间取代 (3)乙醇和HX反应
(2)消去反应
(3)氧化反应
有机物的氧化反应、还原反应的含义:
氧化反应:有机物分子中失去氢原子或加入氧原子的反应(失H或加O)
还原反应:有机物分子中加入氢原子或失去氧原子的反应(加H或失O)