课程内容
《金属的电化学腐蚀与防护》
我国每年因金属腐蚀造成的损失占国民生产总值(GNP)的2%-4%,钢铁因腐蚀而报废的数量约占钢铁当年产量的25%-30%。全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
思考与归纳:
金属被腐蚀后有什么危害?
(1)外形、色泽、机械性能发生变化;
(2)影响机器、仪表设备精度和灵敏度,以至报废;
(3)桥梁、建筑物强度降低而坍塌;
(4)地下金属管道泄漏;
(5)轮船船体损坏;
(6)金属腐蚀还可能造成环境污染。
一、金属的电化学腐蚀
1、金属腐蚀:
金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
实质:发生氧化还原反应 M-ne-=Mn+
2、金属腐蚀的类型
(1)化学腐蚀
金属与接触到的干燥气体(如O2、Cl2、SO2)或非电解质液体(石油)等直接发生化学反应引起的腐蚀叫做化学腐蚀。
(2)电化学腐蚀
不纯的金属与电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀。
化学腐蚀和电化学腐蚀的比较
| 化学腐蚀 | 电化学腐蚀 | |
| 条件 | 金属跟接触的物质反应 | 不纯金属跟电解质溶液接触 |
| 现象 | 不产生电流 | 有微弱的电流产生 |
| 反应 | 金属被氧化 | 较活泼的金属被氧化 |
| 影响因素 | 随温度升高而加快 | 与原电池的组成有关 |
| 腐蚀快慢 | 相同条件下较电化学腐蚀慢 | 较快 |
| 相互关系 | 化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍 | |
3、金属腐蚀速率的快慢
规律:
·电解原理引起的腐蚀大于原电池原理引起的腐蚀大于化学腐蚀大于有保护措施的腐蚀
·活泼性不同的两种金属,活泼性相差越大,金属越活泼,腐蚀越快
·同种金属的腐蚀在强电解质溶液中大于弱电解质溶液大于非电解质溶液
·对同一电解质溶液来说,电解质溶液浓度越大,金属的腐蚀越快
想一想:钢铁在干燥的空气里长时间不易被腐蚀,但在潮湿的空气里却很快被腐蚀,这是什么原因呢?
在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水能电离出少量的H+和OH-,同时由于空气中CO2的溶解,使水里的H+增多:
H2O+CO2
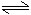 H2CO3
H2CO3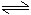 H++HCO3-
H++HCO3-这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。
钢铁的析氢腐蚀和吸氧腐蚀比较
| 析氢腐蚀 | 吸氧腐蚀 | |
| 条件 | 水膜呈酸性 | 水膜酸性很弱或呈中性 |
| 负极Fe(-) | Fe-2e-=Fe2+ | 2Fe-4e-=O22+ |
| 正极C(+) | 2H++2e-=H2↑ | O2+2H2O+4e-=4OH- |
| 总反应 | Fe+2H+=Fe2++H2↑ | 2Fe+2H2O+O2=2Fe(OH)2 进一步反应 4Fe(OH)2+2H2O+O2=4Fe(OH)3→Fe2O3·nH2O |
| 联系 | 通常两种腐蚀同时存在,但以吸氧腐蚀为主 | |
练习
如图,水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈_______性,发生_______腐蚀,电极反应式为:负极:______________,正极:______________。
(2)若液面下降,则溶液呈_______性,发生_______腐蚀,电极反应式为:负极:______________,正极:______________。
三、金属的防护方法
交流·研讨:自行车在月球会不会生锈?深圳和敦煌哪个地区的钢铁容易生锈些?谈谈自行车的防护措施,哪些方法可以防止金属的腐蚀?(从内因、外因两个方面的因素来考虑)
4、金属的防护
(1)腐蚀因素:金属本性、介质
(2)方法
a、涂层:表面涂矿物性油脂、油漆、覆盖搪瓷
b、电镀、喷镀:白铁皮(Zn)、马口铁(Sn)
c、表面钝化:枪炮表面致密的Fe3O4保护膜
d、合金:不锈钢——铁铬合金
e、电化学保护法——外加电流的阴极保护法
原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
练习
下列事实不能用电化学理论解释的是( )
A、轮船吃水线以下的船壳上装一定数量的锌块
B、铝片不用特殊方法保护
C、纯锌与稀硫酸反应时,滴入少量的CuSO4溶液后速率加快
D、镀锌铁(在铁上镀一层锌)比镀锡耐用



























